신약개발 기업으로 가는 길 2 (ADC 치료제 이야기)
안녕하세요?
셀트리온 주가가 계속 누군가에 의해 관리되는 것처럼 (매일 호가창에서 18, 18, 18 44, 444, 4444주를 보여주는 그놈들 ㅜ) 지지부진한 상황입니다.
역시나 단기매매를 위해 셀트리온 투자를 생각하시는 것은 성공하기 어려운 투자전략이며, 보다 큰 관점에서 셀트리온의 발전과 호흡의 크기를 조절해야 셀트리온과의 동행에 실패하지 않을 것이라 생각합니다. 물론 저도 단기적 주가 흐름에 실망도 하고 화도 나지만 이런 때에는 일수록 본업에 충실하며 "보다 큰 관점에 주목" 하려 노력하고 있습니다.
이제 말씀 드릴 때가 된 듯해서 신약 이야기를 드리려 하는데....셀트리온을 신뢰하시며 장투하고자 하시는 주주님들은 주가의 부침을 저만큼 내려 놓으시고 저와 함께 신약의 과실의 꿈을 그려 보심이 어떻신지요?^^
(아래의 ADC 신약 이야기는 셀트리온 장기투자 주주로서의 바램이 포함되어 있을 수 있습니다. 11월 전임상 발표후에도 최종 3상 성공까지 많은 시간이 필요하며, 전임상에 성공했더라도 항암제의 임상3상까지의 성공확률이 일반적으로는 5% 내외에 불과하다는 점을 감안해 주셨으면 합니다. 또한 ADC 치료제는 바이올로지(Biology)도 중요하지만 대부분 케미스트리(Chemistry) 분야가 많아서 제가 설명 드릴 내용에 한계가 있음도 말씀 드립니다)
몇일전 뉴스 기사를 보신 것처럼 "셀트리온이 ADC 신약 2종을 오는 11월 월드 ADC 학회에서 비임상 데이터와 함께 공개하고 25년에는 본격적인 임상 절차에 돌입한다"라는 기사가 있었습니다.
저는 개인적으로 "1. 드디어 제가 기다리던 ADC 신약 개발이 본격화 되는구나^^" 라는 소회와 함께 "2. 25년에는 2nd Wave와 함께 4th Wave가 함께 출렁일수도 있겠네!!"라는 기대가 생겼습니다.
(이에 관한 의견을 전해 드리기 위해 ADC 신약 이야기를 어떻게 써야 하나 고민하고 내린 결론은...(1) 셀트리온 주주님들께서 어느 정도 ADC 치료제에 대해서 공부를 하셨을 것이라는 전제하에서 정리하되 (2) 셀동행 카페인 만큼 최대한 이해하시기 쉽게 정보를 전해 드리자..라고 생각했습니다. (3) 신약분야가 워낙 어려운 분야로 디소 난해할 수 있으나 셀트리온의 ADC 내에서의 포지셔닝을 아셔야 하기에 방대한 내용 그대로 전달해 드립니다.)
우선 셀트리온 홈페이지에 가시면....아래와 같이 "항체-약물 접합기술이란?" 이라는 메거진을 통해 ADC의 기초지식을 쉽게 접하실 수 있습니다. (미디어센터=>매거진)
1. 가장 Hot한 항암 Modality ADC 치료제 개요
- ADC 치료제는 2000년 화이자의 Mylotag이 FDA 승인을 받았으나 강한 독성 부작용 등으로 주목받지 못하다가,
- 2013년 로슈사의 Kadcyla가 1세대 ADC 치료제의 문제들을 보완하며 HER2 유방암 치료제로 크게 각광을 받기 시작했고,
- 2019년 FDA 승인된 Enhertu가 2022년 ASCO에서 인상적 임상결과 발표로 기립박수를 받으며 ADC 치료제의 대표주자로 급부상하며 ADC를 가장 핫한 항암 모달리티 반열에 올려 놓았음
- 엔허투는 놀라운 임상결과 보여주며 2024년 4월 IHC 검사 3이상인 경우, HER2 양성 뿐만아니라 암종 불문하고 고든 고형암 환자에게 사용 가능하도록 FDA 승인이 이루어짐
2. ADC 치료제는 항체 (Antibody) + 약물 (Drug/Payload) + Linker로 구성됩니다.
(1) 항체 (Antibody)
- ADC에서 요구하는 이상적 항체는 항원 에피토프에 대한 강한 결합력, 낮은 면역원성 (인간항체) 등이며
- 주주님들께서 알고 계신바와 같이 셀트리온은 이미 위 기술을 갖춘 항체 개발에 강점이 있는 회사로 ADC 치료제를 위한 항체 개발은 어느 회사보다도 훌륭히 해 낼 것을 믿어 의심치 않습니다.
(국내 ADC 치료제 개발사중.......항체를 직접 ADC로 엔지니어링 하여 개발할 수 있는 회사는 거의 없는 상황임)
(2) 그럼 약물(Payload)는 어떨까요?
- 적절한 독성의 Payload를 선택하는 것는 약물의 MTD(최대허용용량), Therapeutic window(치료범위), side effect 최소화 등에 큰 영향을 주며...특히 세포막 투과성 확보 여부에 의한 방관자 효과(Bystander Killing Effect) 가능 여부도 결정됩니다
- 장투 주주님들은 아시겠지만...셀트리온은 ADC에 아주 오래전부터 진심인 회사입니다. 이 이야기를 위해서는 과거 CT-P26 이야기로 거슬러 올라가야 합니다.
- 셀트리온은 허쥬마를 개발하던 중 로슈사가 허셉틴의 ADC인 케사일라를 개발하자 이에 대한 대항마로 CT-P26을 개발하기 시작했고 (제가 셀트리온 장투 주주가 된 이유이기도 합니다)
2012년 CT-P26의 Payload인 "돌라스타틴 10 유도체" 에 대한 특허신청으로 2015년 특허를 취득 하게 됩니다.
(참고1) "dolastatin 10"은 dolabella auricularia (쐐기바다토끼) 추출물에서 분리된 천연해양물이며, dolastatin 10의 수용성 합성 유사체인 Auristain은 대표적 Microtubule Inhibitors (미세소관 억제제) Payload중 하나 입니다.
(참고2) Payload는 크게 Microtubule Inhibitors (미세소관 억제제)와 DNA binding drug (DNA 손상제)로 구분되며
Microtubule Inhibitors (미세소관 억제제)는 monomethyl auristatin E (MMAE), monomethyl auristatin F (MMAF)와 같은 Auristain계 (dolastatin 10의 합성 유사체)와
DM1,DM4와 같은 Maytansinoid계 (maytansine의 합성 유도체)로
DNA binding drug (DNA 손상제)는 calicheamicin, camptothecin, pyrrolobenzodiazepines(PBD) 등으로 구분되며 이중 Camptothecin계인 SN-38과 Dxd는 각각 Trodelvy와 Enhertu의 페이로드로 사용됨
- 이렇듯 셀트리온은 이미 10여년 전부터 ADC 치료제를 차세대의 중요한 치료 Modality로 주목하기 시작했고 이를 개발하기 위해 오래전부터 기술력을 축척해 오고 있었기에 개인적으로는 시장의 기대보다 휠씬 높은 확률로 신약개발을 해 낼 것을 기대하고 있습니다.
- 10여년 전에 ADC의 가능성을 예상하고도 그간 강력히 개발이 이루어지지 못했던 것은 아마도 경영의 안정과 주주보호를 위해 신약개발의 실패 가능성을 이겨낼 수 있는 펀더멘탈 체력 확보와 기술 축적으로 실패 가능성을 최소화하기 위한 최적의 시점을 찾고자 했을 것으로 추정됩니다 (물론 개인적으로는 매우 아쉬워 하고 있습니다)
(3) Linker 기술 ; 절단형 여부 및 항체 접합 기술
- 혈장내 안정성이 확보되어야 하며 적합한 조건에서 표적세포로 약물 방출 가능해야 하는 ADC에서 가장 중요한 기술임
- 크게 절단형(Cleavable) 링커 [Acid-labile linker, Oxidation-reduction reaction linker, Enzyme-labile linker]와 비절단형 링커 [Thioether linker}로 구분됨
- 항체접합 기술은 크게 "라이신의 아민 그룹과 링커에 도입된 NHS (N-HydroxySuccinunmide)와의 반응을 이용한 방법"과 "항체에 존재하는 시스테인의 티올 그룹과 링커에 도입된 말레이미드와의 반응을 이용한 방법"으로 구분됨 (아래 참고1,2 패스하셔도 됨^^)
(참고 1) "항체에 추가적인 시스테인을 도입하는 THIOMAB 기술", "빠른 속도로 생물직교클릭반응이 가능한 비천연 아미노산을 항체에 도입하여 링커를 접합하는 방법"," sortase, transglutaminase와 같은 효소가 인지할 수 있는 펩타이드 서열을 항체 도입하여 링커를 접합하는 방법" 등이 개발중이며
(참고 2) 항체의 아미노산 서열의 변경 없이 항체와 링커를 접합하는 방법으로...
시스테인 리브리징은 항체의 이황화결합을 환원시킨 후 생겨난 티올 그룹에 다른 링커를 도입하는 방법으로 항체에 존재하는 모든 이황화결합에 도입될 경우 균질한 ADC 제조가 가능하며
항체에 친화도를 갖는 펩타이드를 사용한 affinity guided 접합 방법은 전처리과정 없이 위치 특이적이고 균질한 ADC를 만들 수 있음
3. ADC 기술의 발전단계
(1) 1세대 ADC
- 2000년 FDA 승인된 gemtuzumab ozogamicin (Mylotarg)으로 대표됨.
- hydrazone 링커가 산불안정하여 비표적위치에서 독성약물이 방출되는 부작용이 있었고, 페이로드 calicheamicin이 소수성 분자이기 때문에 항체 응집을 일으키기 쉬우며, 짧은 반감기와 면역원성 결함이 있었음. Conjugation(접합)은 lysine 및 cysteine 잔기에 비특이적으로 결합시키는 것을 기반으로 제작되기 때문에 불균일한 DAR을 초래하게 됩니다.
(참고) DAR(drug-antibody ratio)는 약물-항체 비율로 1세대 ADC는 원하는 위치가 아닌 항체와 약물이 비특이적 위치에 불균일하게 접합되어 DAR가 일정하지 못함
DAR가 너무 높으면 약효는 강하나 독성 부작용이 커질 수 있기에... DAR를 일정하게 유지하여 ADC에 부착될 페이로드의 양을 적절하게 조절하는 것이 매우 중요함
(2) 2세대 ADC
- 2013년 승인된 trastuzumab emtansine (Kadcyla)로 대표됨
- auristatins 및 mytansinoid와 같은 수용성 결합 효율이 향상된 보다 효과적인 세포독성 약물을 사용, 링커도 개선되어 보다 높은 혈장 안정성과 균일한 DAR을 제시하였음
- 하지만 여전히 표적 외 독성으로 인한 부작용과 DAR가 높을 경우 나타나는 ADC의 응집이 발생하는 등 개선할 사항이 남아 있었음
(3) 3세대 ADC
- 2019년 승인된 trastuzumab deruxtecan (Enhertu)가 대표적임
- 부위별 생체 접합 기술의 도입으로 인해 체계적으로 특성화된 DAR과 목적하는 세포독성을 보유하는 균일한 ADC가 생산됨
- 표적 외 독성이 적고 약동학적 효율이 우수하며, 면역원성을 감소시키기 위해 완전 인간화 항체를 활용하였고, 순환계에서 안정적이고 종양세포에 더 쉽게 내재화될 수 있는 Fab (antigen-binding fragment)의 개발이 활발히 이루어지고 있음
4. 3세대 ADC의 대표주자인 Enhertu Deep Dive !! (엔허투가 셀트리온을 포함 ADC 신약 상업화의 허들이 될 수 있기에 자세히 말씀 드립니다)
(1) 개요
- 엔허투는 아스트라제네카와 다이이찌산쿄가 공동개발한 ADC로 trastuzumab(항체) + Cleavable linker (절단형링커) + deruxtecan (페이로드)임
- 2019년 FDA 승인후 2022년 ASCO에서 추가 발표된 임상결과로 참석의사들로부터 기립박수를 받으며 현재 ADC 시장을 석권하고 있음
(2) 주요 특징
- 탁산(taxane) 대비 독성이 낮은 DXd라는 Topoosomerase I Inhibitor (국소이성질화 효소 I 저해제)를 사용하였는데 ..이로서 DAR를 8개 정도로 높여 나타날 수 있는 세포독성 부작용을 최소화 하기 위한 의도로 보임
- CGFG 기반의 친수성 링커를 통해 혈장내 안정성을 확보하여 3주 가량의 반감기 확보로 안정적 항암효과를 지속할 수 있으며, 암세포 리소좀(lysosome)내부에 특이적으로 많이 존재하는 Cathepsin B 효소에 의해 링커가 절단 => 세포질로 화학독성약물을 방출하게 됨
- DXd는 Camptothecin계 페이로드로 중국 남부에 자생하는 나무인 희수나무(Camptotheca acuminata)에서 추출한 성분으로 만들어진 DNA 회전효소 억제제이며, 소수성이 커서 세포막을 투과하여 주변 종양 세포에도 영향을 미치는 bystander effect를 보여 target cancer cell뿐만 아니라 non-target cancer cell도 효과적으로 제거할 수 있는 페이로드임 (엔허투의 가장 중요한 특징임)
(참고) 소수성 (hydrophobic) : 물분자와 결합하지 못하는 성질로 소수성이 있어야 지질형태의 세포막을 투과할 수 있음 Vs 친수성 (hydrophilic) : 물과 강하게 상호작용을 하고 강한 친화력이 있는 성질
(3) 기립박수를 받은 임상결과 분석
- 엔허투와 화학항암제를 비교 임상한 DESTINY-Breast04
1) PFS (Progression-Free Survival ; 무진행 생존기간) 분석
- mPFS (median PFS): 엔허투 10.1개월 Vs (의사선택) 화학항암제 5.4개월 => 위험도 49% 감소를 의미
2) OS (Overall Survival : 전체 생존기간) 분석
- mOS (median OS) : 엔허투 23.9개월 VS 화학항암제 17.5개월 => 6.4개월 추가 생존 (위험도 36% 감소를 의미)
(4) 위 임상결과로 왜 엔허투가 시장의 표준이 되었는지 정리해 보면
1) "HER2-Low"라는 새로운 환자군 개념을 정립하고 타켓화함
- 유방암 환자구분
=> "HER2 양성" : 15~20%, "HR 양성/HER2 음성" : 약 70% (대다수), "HR음성 / HER2 음성 (삼중음성)" : 10~15%
- HER2 음성군 (Low 포함) 환자 60% 이상을 타켓화하여 OS를 평균 6개월 이상 연장시킨 놀라운 결과 발표로 2022년 ASCO에서 기립박수를 받음
2) 독성이 비교적 낮은 deruxtecan 이라는 페이로드 사용하였는데 HER2 양성 암세포에 들어가 분해된 후 높은 세포막 투과성 (membrane permeability) 특성으로 세포막을 투과하여 근처의 HER2-low 암세포로 확산되어 암세포를 제거함 (의도된 Bystander Killing Effect)
3) 2024년 4월 면역조직화학검사 (IHC) 3이상 HER2 양성인 경우(HER2-low) 암종 불문하고 모든 고형암 환자에게 사용 가능하도록 FDA 허가됨
5. 셀트리온은 ADC 기술력을 축적을 위해 많은 노력을 해 왔는데...
(1) 2019년 캐나다 아이프로젠의 ADED 플랫폼 활용 ADC 공동개발 계약을 체결하였음 (아이프로젠 진행사항 정보는 부재하여 추가설명 생략함)
(2) Iksuda Therapeutics 지분 투자
미래에셋그룹과 함께 영국 ADC 플랫폼 기업 Iksuda Therapeutics에 지분 투자를 단행하여 최대주주가 되었는데... Iksuda Therapeutics는 국내 리가켐 바이오의 ConjuAll 플랫폼 기술을 활용하는 계약을 맺고 있습니다.
- Iksuda의 "PermaLink" 와 리가켐의 "ConjuAll "기술을 사용하여 야생형 또는 특이적 위치에 항체에 대한 안정적인 접합을 하는 ADC 항체 접합 기술 플랫폼을 쓰고 있습니다.
- Iksuda의 "PermaLink" 와 리가켐의 "ConjuAll "을 활용한 임상결과를 보면
< 혈장 안정성 측면(DAR) PermaLink-ADC(IKS012), ConjuAll ADC(IKS03)를 전통적인 말레이미드 접합 ADC(Adcetris)와 비교>
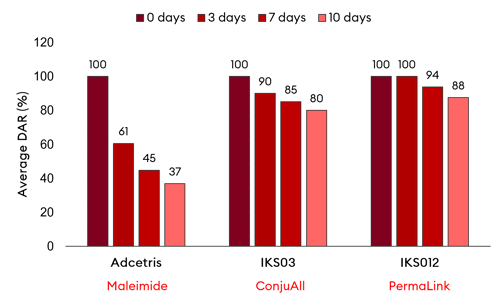
=> PermaLink가 가장 높은 ADC 안정성을 보이며, 7일 후 DAR 감소가 최소로 나타났음 (Adcetris는 해당 기간 동안 DAR이 55% 감소했고, 3일 후 39% 감소가 분명했음
PermaLink와 ConjuAll 두 플랫폼 모두 안정적 DAR를 확보할 수 있는 매우 우수한 플랫폼임을 확인할 수 있음
=> 특허침해를 피해갈 수 있는 범위내에서 셀트리온의 ADC 신약 개발에 있어 두 플랫폼 기술에 영향을 맞아 매우 안정적 DAR를 확보하는 기술력을 확보 했을 가능성이 높아 보입니다.
하지만 두 플랫폼 모두 엔허투가 보여준 바와 같은 의도된 방관자효과에 의한 HER2-low를 포함한 표적항원 인식이 어려운 고형암종을 타켓으로한 항암효과를 기대할 수 없기에 2.5세대 기술이라는 한계를 극복해야 하는 상황입니다. (개발에 성공하더라도 엔허투의 아성으로 상업화 성공을 기대하긴 쉽지 않아 보이기 때문입니다)
(3) 피노바이오와의 플랫폼 기술활용 마일스톤 계약
- 셀트리온은 2022년 피노바이오와 최대 15개의 타깃에 피노바이오의 ADC 링커-페이로드 플랫폼 'PINOT-ADC™'를 활용할 수 있는 권리를 확보하는 계약을 맺었고, 최근 "피노바이오에게 플랫폼 기술 활용에 대한 마일스톤을 지급하고, 연내 ADC 파이프라인 2종을 공개할 계획"이라고 발표했습니다.
- 피노바이오 홈피에서 강조된기술력은 아래와 같습니다.
1) FL118(피노테칸) 이라는 Topoosomerase I Inhibitor Payload를 사용하였습니다
- 피노바이오에서 특허 출원한 FL118 (이하 피노테칸) 이라는 엔허투와 같은 Camptothecin계 페이로드를 사용하였는데, 높은 소수성으로 세포막 투과성을 확보하여 타켓 암세포 주변 암세포까지 저해하는 Bystander Effect가 가능하며
- 피노테칸은 전임상 실험결과 캄토테신계 SN-38(이리노테칸 ; 트로델비 페이로드)에 비해 5배~20배 이상 강력하면서도 동등한 수준의 안전성을 보여주었습니다 (월등한 Therapeutic Window)
- 피노테칸은 1 나노몰 ~ 10 나노몰 정도의 낮은 농도로 처리해도 MCl1이라든가 CIAB2와 같이 고형암에서 내성을 유도하는 antiapoptotic 단백질의 발현을 억제 가능함.
(피노테칸은 세포막에서 약물을 밀어내는 efflux pump 기능을 하는 ABCG2 단백질을 회피하는 특성이 있음)
=>암세포 증식에 관여하는 효소를 저해함과 동시에 암세포 사멸을 막아주는 단백질까지 억제하는 이중기전
2) 새로운 기능성 Cleavable Linker를 독자 개발하였습니다.
- 두 종류의 효소가 순차적으로 작용할 때만 약물이 방출되도록 설계한 "순차절단 링커"
(단일효소 절단 링커는 세포 밖에서 약물이 부분적으로 방출돼 전신에 독성을 일으킬 수 있었기에 안정성이 크게 강화됨 ; 세포 외부에서 유리되는 약물 양이 기존 링커 대비 약 10배 이상 낮으며 ADC의 약물 타깃을 발현하지 않는 정상 세포로 흡수되는 양은 기존 ADC 대비 2배 이상 줄었음)
- 획기적으로 높아진 친수성을 확보함 (기존 소수성 링커는 정상세포에 잘 달라붙고 독성을 유발)
=> 웬만한 지용성 페이로드를 붙여도 물에 잘 녹기 때문에 안전성이 뛰어남 (링커 친수성+페이로드 소수성을 접합하는 기술력이 매우 돋보임)
(피노바이오 종합) 피노바이오의 ADC 플랫폼은 안정적 DAR 확보를 기반한 2.5세대 기술 Iksuda Therapeutics 및 deruxtecan이라는 캄토테신 계 Payload를 활용, 의도된 Bystander Killing Effect로 HER2-low 치료제라는 새로운 지평을 만들어낸 3세대 기술 Enhertu을 뛰어 넘을 수 있는 기술력을 확보하였다 평가할 수 있습니다. (왜 익수다 지분투자를 넘어서 피노바이오와 협력계약을 체결했는지를 확인하실 수 있음)
무엇보다도 탄탄한 시험관 내(In vitro)·생체 내(In vivo) 임상 데이터를 확보하여 우수한 플랫폼임을 POC (Proof of Concept) 증명하는 것이 중요한데..
최근 셀트리온이 위 기술 실시 옵션 행사에 따라 마일스톤을 지급할 예정할 예정이며 오늘 11월에 미국 샌디에이고에서 열리는 "World ADC Conference"에서 2종의 ADC에서 전임상 데이터를 발표할 예정인 것으로 판단컨데 전임상 In vivo POC 데이터까지는 이미 확보한 것으로 예상할 수 있습니다.
6. 셀트리온이 발표할 ADC 치료제를 예상해 본다면..
1) 항체는 당연히 셀트리온의 자체 엔지니러링 된 항체를 사용할 것입니다. (국내 ADC 개발 회사중 유일함)
=> 항체가 결합할 타켓 표적항원에 따라 사용될 항체를 예상해 본다면 (아래중 2개)
- 유방암, 위암, 난소암 등에서 과발현이 뚜렸한 HER2 항원을 타켓으로 하는 항체 : trastuzumab (허쥬마 항체 ; 기 보유)
- 림프종, 만성 림프구성 백혈병 등에 과발현되는 CD20 항원을 타켓으로 하는 항체 : Rituximab (트룩시마 항체 ; 기 보유)
- 비소세포폐암, 편평세포암 등 다양한 암종에서 발현율이 높게 나타나는 TROP2 항원을 타켓으로 하는 항체 : Sacituzumab (길리어드 사이언스 트로델비 등의 항체 ; 신규 개발)
(참고 TROP2 항원 활용 트로델비는 PFS,OS 등이 엔허투를 넘지 못하고 있고 최근 아스트라제네카와 다이이찌산쿄의 "Dato-DXd" 역시 임상 3상에서 전체 생존율(OS)을 개선하는 데 실패하는 등 TROP2 항원 타켓 ADC개발은 고전하고 있는 분야임 ; 개발에 성공 (OS/PFS 모두 엔허투 능가)한다면 Best-in-Class가 될 수 있는 상황임 ; 리가켐 바이오의 급등이유이기도 함)
2) Payload는 피노바이오의 피노테칸 (Camptothecin계) 기술을 채택하여 개발된 Drug를 사용하였을 확률이 높아 보입니다,
- 월등한 Therapeutic Window 확보, 의도된 Bystander Effect로 HER2-low 환자까지 타켓 ; 상업적 가치 극대화, 암세포 증식 관여 효소 저해+ 암세포 사멸 방해 단백질 억제의 이중기전
- TROP2 항원 타켓인 경우 CT-P26 특허의 dolastain10 유사체 합성 Auristain계 MMAE 또는MMAF의 활용 가능성도 있으나, 이 경우에는 기존 기전에 친수성 및 안정성을 강화하는 추가적인 엔니지어링 작업이 있었기를 기대합니다.
3) Linker는 익수다/리가켐 기술의 장점을 참고(특허를 침해하지 않는 범위내)하여 최적화된 DAR를 구현, ADC의 안정성을 극대화할 가능성이 높아 보이며
이에 피노바이오의 친수성을 획기적으로 증대한 "순차절단 Cleavable Linker"을 더해 최적화된 ADC 치료제를 추구할 것으로 판단됩니다.
---------------------------------------------------------------------------------------------------------------------------------------------------------------------
(의견 종합) 장황하게 여러가지를 말씀 드렸으나, 주주님들께서 꼭 알아주셨으면 하는 내용은 아래와 같습니다
1. 셀트리온은 오래전부터 ADC 치료제를 주목해 왔고 강점이 있는 기존 항체기술력에 더해 이미 Payload의 특허까지 보유하고 있었으며, 발전하고 있는 기술력을 따라 잡고자 여러 회사의 장점을 Follow-up 하며 오랜 기간 준비해 왔습니다.
2. 시장에서 오랫동안 보아 오신 것처럼 많은 회사들이 신약 개발에 도전했지만 연구개발 부족, 상업화 성공 가능성 분석 없는 무모한 임상도전 등으로 큰 상처를 남긴 사례들을 보았습니다. 하지만, 셀트리온은 ADC 시장의 성공을 누구보다 먼저 Finding 했으면서도 위험있는 도전 보다는 실패의 가능성을 최소화하기 위해 기술 축적과 최적의 타이밍을 찾고자 했음을 알 수 있습니다. (주가 부진으로 혹자는 서회장님께 비난의 화살을 돌리고 있지만...저는 개인적으로는 회장님의 주주에 대한 배려심에 깊은 감사 인사를 드리고 싶습니다. 단기적 주가 변동 보다는 큰 관점에서 셀트리온과 호흡의 크기를 맞추기실 추천 드립니다.)
3. 시장은 전혀 셀트리온의 ADC 치료제 개발에 대해 주목하고 있지 않지만....위와 같은 내용으로 판단하신다면...매우 성공 가능성이 높은 ADC 치료제 개발이지 않을까 하는 기대감을 가지셔도 되지 않을까요 라고 감히 말씀 드리고 싶습니다. 셀트리온의 신약 개발 성공 기업으로의 도약을 진심으로 기원하며 응원하고 싶습니다. 감사합니다.
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
P.S. 누군가는 3분기 짐펜트라 실적이 부진할 수 있다는 예측에 불안해 떨며 회사를 비난하고 있지만 누군가는 3분기가 좀 약하면 결국 4분기 또는 내년 1분기에는 급증하겠지 하며 주식을 더 모으고 있습니다. 조삼모사 같은 게임에서 승자는 과연 누가 될까요? ㅎ